血流動力學監測是重症醫學、心血管疾病診療等領域的“生命線”——通過評估心臟功能、血管阻力、組織灌注等核心指標,為疾病診斷、治療方案制定及預後判斷提供關鍵依據。然而,傳統血流動力學監測手段長期面臨“主觀性強、操作複雜、依賴經驗”的痛點,制約着臨牀決策的精準度與效率。隨着量化技術的突破,以“客觀數據”替代“主觀判斷”的量化血流動力學新時代已到來,其核心價值在於通過標準化、可量化的指標體系,減輕醫生負擔、消除主觀偏差,為臨牀決策注入“數據驅動”的確定性。
傳統血流動力學監測的痛點:主觀性、複雜性與侵入性的三重桎梏
在量化技術普及前,臨牀血流動力學評估無論是無創還是有創手段,均存在顯著侷限,共同制約着監測的精準度與效率。
1. 主觀判斷主導,結果一致性差
傳統無創監測手段中,許多關鍵指標依賴醫生對圖像、波形的“定性解讀”。以心肌收縮力評估為例,心臟超聲需通過“室壁運動分析”判斷心肌收縮功能——醫生觀察左心室各節段室壁的運動幅度、增厚率及協調性,進而分級(如正常、運動減低、無運動)。但這一過程受圖像質量(如肺氣干擾、肥胖患者成像模糊)、醫生經驗(不同年資醫生對“運動減低”的界定差異)等因素影響,不同中心、不同醫生間的評估一致性常不足60%,易導致誤診或治療延遲。
2. 操作複雜耗時,醫生負擔沉重
傳統技術不僅主觀,還伴隨複雜的操作與數據分析流程。心臟超聲完整的室壁運動分析需醫生手動勾勒心內膜邊界、逐節段評分,單例患者分析耗時10-15分鐘;若結合射血分數、E/E'比值等指標,時間進一步延長。在ICU等高強度場景中,醫生需同時管理多名危重患者,此類“高耗時操作”會加劇工作負擔,甚至因時間緊迫簡化評估,犧牲數據完整性。
3. 有創監測的侵入性風險與操作門檻
部分傳統監測依賴有創手段(如肺動脈導管、動脈導管)獲取量化數據,但存在“侵入性風險高、操作門檻高”的侷限:
侵入性併發症:肺動脈導管(PAC)需經頸內/鎖骨下靜脈置入右心至肺動脈,可能引發心律失常、感染、肺動脈破裂等併發症,嚴重時危及生命;
操作門檻高:需專業醫生操作,且置入後需持續校正零點、排除呼吸乾擾(如機械通氣患者需在呼氣末記錄數據),數據解讀複雜;
動態監測受限:有創監測多為“間歇性採樣”(如每小時記錄一次心輸出量),難以捕捉血流動力學的快速變化(如術後急性心衰的驟發)。
例如,PAC雖能提供心輸出量、肺動脈楔壓等量化指標,但因上述侷限,其臨牀應用已逐漸被無創量化技術替代。
這些痛點共同指向一個核心問題:傳統模式下,“主觀性”“複雜性”“侵入性”相互疊加,使血流動力學監測成為臨牀決策的“不確定環節”。而量化血流動力學的崛起,正是通過“無創化、自動化、指標量化”破解這一困局。
量化血流動力學的核心價值:以“數據標準化”實現“減負”“去主觀化”與“無創化”
量化血流動力學的本質,是通過技術創新將傳統“定性描述”或“有創採樣”的指標轉化為無創、可直接測量、數值化呈現、標準化解讀的量化參數。其核心優勢體現在三大維度:
1. 減輕醫生負擔:從“手動操作”到“自動輸出”,釋放人力成本
量化技術通過集成傳感器、算法模型與自動化分析系統,將傳統需“人工操作、主觀判斷”的流程轉化為“一鍵式數據輸出”。例如,阻抗法血流動力學監測技術(如BioZ)通過貼敷於胸腔的電極片,持續監測胸腔阻抗變化,結合心電、血壓信號,自動計算心輸出量、外周血管阻力、心肌收縮力等核心指標,全程無需醫生手動干預,單例患者監測數據獲取時間從傳統技術的10分鐘以上縮短至30秒內。這種“自動化、標準化”的流程,大幅減少了醫生在數據採集與初步分析上的時間投入,使其能聚焦於更核心的臨牀決策環節。
2. 消除主觀偏差:以“客觀數據”替代“經驗判斷”,提升結果可靠性
量化指標的最大價值在於“客觀性”——通過物理原理(如阻抗變化、壓力波形特徵)直接計算指標數值,避免人為解讀的不確定性。例如,心肌收縮力的量化指標(如BioZ的ACI)、容量狀態的量化參數(如BioZ的TFC)等,均以具體數值呈現,結果不受醫生經驗、操作習慣或視覺誤差影響,不同場景、不同操作者間的一致性可達90%以上。這種“數據説話”的模式,為多中心研究、遠程會診及標準化診療提供了統一的“語言”。
3. 無創化監測:規避有創風險,實現動態連續評估
量化技術以“無創”為核心優勢,通過體表傳感器(如電極片、指套)採集信號,避免有創操作的併發症風險。同時,量化監測支持“連續動態監測”(如每2秒更新一次數據),可實時捕捉血流動力學的細微變化(如術後急性心肌收縮力下降、容量負荷過重的早期預警),為治療調整提供“實時反饋”。
從“室壁運動”到“ACI”,從“胸片估肺水”到“TFC”:BioZ量化指標如何重塑血流動力學評估?
量化血流動力學的優勢,可通過BioZ的核心量化指標直觀體現——其基於阻抗法原理,不僅實現了心肌收縮力的量化(ACI),還創新推出胸腔液體含量(TFC)等獨有的容量評估指標,使血流動力學評價從“單一維度”走向“多維度整合”。
1. ACI:心肌收縮力的“量化錨點”,阻抗法獨有的心肌功能指標
心肌收縮力是反映心臟泵血功能的核心指標,傳統心臟超聲依賴“室壁運動主觀分級”,而BioZ通過阻抗法直接量化心肌收縮力,核心指標為ACI(Acceleration Index,加速度指數):
定義:主動脈血流加速度的峯值,單位為m/s²,反映心肌收縮的“爆發力”——ACI越高,心肌收縮力越強;
優勢:
o 完全客觀量化:由設備通過算法自動計算,數值化呈現(如正常範圍:男性70-150,女性90-170),無需醫生主觀判斷;
o 無創連續監測:電極片貼敷即可,每2秒更新一次數據,可捕捉心肌收縮力的快速變化(如正性肌力藥物起效後的10分鐘內數值升高);
o 結果穩定可靠:不受圖像質量、醫生經驗影響,不同操作者間一致性>90%。
例如,一名感染性休克患者,傳統超聲因“整體室壁運動減低”難以區分是心肌抑制還是容量不足;而BioZ監測顯示ACI顯著降低(如男性患者ACI=50 <70),結合心輸出量指標,可快速判斷為“心肌收縮力衰竭”,指導精準使用多巴酚丁胺治療。
2. TFC:胸腔液體含量的“量化標尺”,容量評估的無創突破
容量狀態評估(如胸腔內血容量、肺水)是血流動力學監測的另一核心,傳統依賴胸片(主觀判斷肺淤血程度)或有創的血管外肺水指數(EVLWI,需PiCCO導管),而BioZ通過TFC(Thoracic Fluid Content,胸腔液體含量)實現無創量化:
定義:基於胸腔阻抗變化計算的胸腔內液體總量(包括血液、肺水、組織間液),反映整體容量負荷狀態;
優勢:
o 無創替代胸片:胸片需搬動患者(危重患者風險高),且“肺淤血程度”依賴醫生主觀判斷(如“輕度/中度肺淤血”),而TFC以數值量化(如正常範圍30-50),結果客觀;
o 動態反映容量變化:輸液或利尿劑治療後,TFC可在30分鐘內出現顯著變化(如利尿劑起效後TFC從45 降至38 ),指導容量調整;
o 聯合ACI實現多維度評估:TFC(容量)+ ACI(心肌收縮力)+ 心輸出量(CO)+ 外周血管阻力(SVR),形成“心肌-容量-血管”的完整血流動力學評估體系。
例如,一名急性心衰患者,傳統胸片提示“雙肺模糊影”(主觀判斷肺水增多),而BioZ監測女性TFC=48 L,結合ACI=90(正常範圍),可判斷為“容量負荷過重”,指導利尿劑精準使用,避免盲目強心治療。
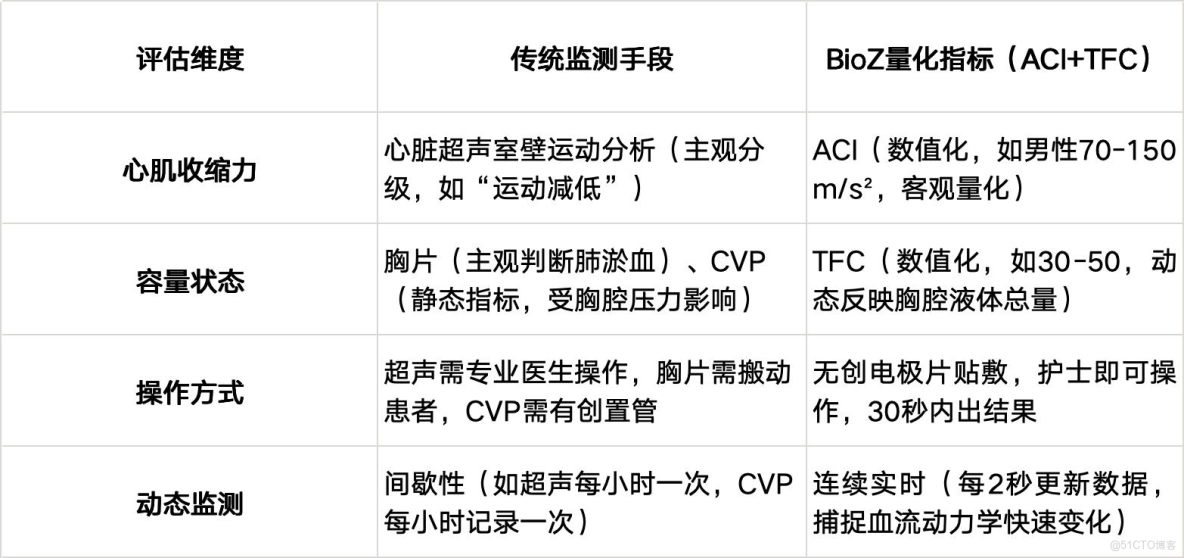
對比:傳統監測與BioZ量化指標的核心差異
通過ACI與TFC的協同,BioZ將心肌收縮力與容量狀態的評估從“模糊定性”升級為“精準量化”,不僅減輕了醫生的操作與分析負擔,更以“客觀數據”消除了主觀偏差,使血流動力學評估成為臨牀決策的“確定性依據”。
量化血流動力學的未來:從“指標量化”到“全程智能”
量化血流動力學的價值遠不止於單一指標的突破,其正在推動整個監測體系向“多維度整合、AI輔助決策”演進。未來,隨着AI算法、多模態數據融合技術的發展,量化監測將實現三大升級:
實時預警:結合ACI、TFC等連續量化數據與AI模型,自動識別血流動力學異常(如ACI驟降+TFC驟升提示急性心衰),提前5-10分鐘預警病情惡化;
精準分型:通過“ACI+TFC+CO+SVR”多指標組合,實現休克、心衰等疾病的精準分型(如“低ACI+低CO+高SVR”提示心源性休克),指導個體化治療;
預後預測:基於長期量化數據建立預後模型(如ACI持續<正常下限的患者死亡率升高3倍),為風險分層提供依據。
結語:以量化之力,開啓精準醫療新徵程
量化血流動力學的崛起,是“數據驅動”對“經驗驅動”的革新,更是“無創化”對“有創化”的替代。從心臟超聲的“室壁運動主觀判斷”到BioZ的“ACI客觀數值”,從胸片的“肺淤血定性描述”到“TFC量化標尺”,量化技術不僅減輕了醫生的操作與分析負擔,更以“標準化、可重複”的特性消除了主觀偏差,讓臨牀決策更精準、更高效。
在精準醫療成為主流的今天,量化血流動力學正以“數據”為筆,重新定義血流動力學監測的標準——未來,隨着技術的持續迭代,我們終將實現“以最小的風險、最低的人力成本,獲取最精準的血流動力學數據”,讓每一位患者都能受益於“數據驅動”的精準守護。