在現代分子生物學和蛋白質科學研究中,重組蛋白的表達、純化和功能分析是科研實驗的基礎內容。為了實現高效的蛋白捕獲、定量檢測和功能驗證,科研人員常採用融合標籤技術。AVI標籤作為一種可被特異性生物素化的短肽標籤,憑藉其高親和力、可控標記和廣泛適配性,在科研試劑體系中得到了廣泛應用。本文從科研技術層面系統闡述AVI標籤的設計原理、生物素化機制、親和純化策略及檢測應用,以期為科研實驗設計和試劑選擇提供清晰嚴謹的參考。
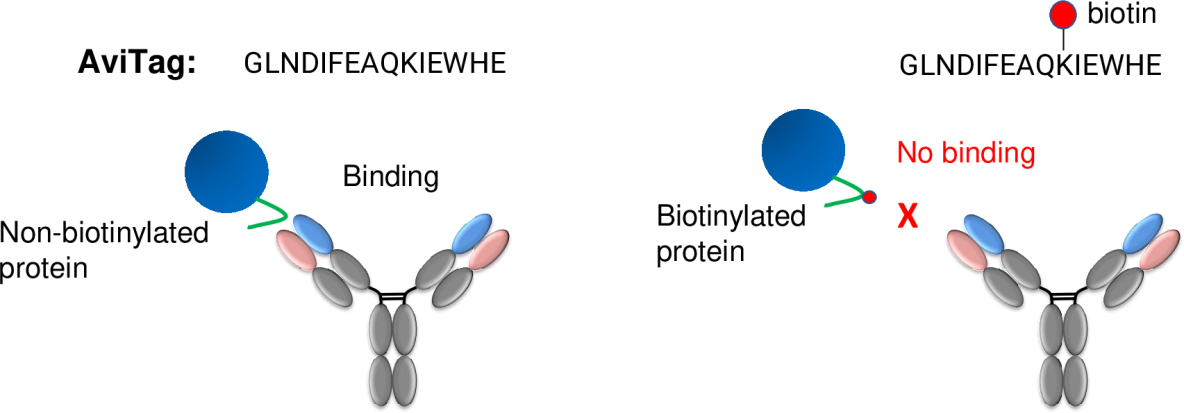
AVI標籤是一類由特定氨基酸序列構成的短肽標籤,其典型長度在15到20個氨基酸之間。設計原則是將一個賴氨酸殘基置於特定序列環境中,以便被生物素蛋白連接酶(BirA)識別並進行共價修飾。與其他常見的融合標籤相比,AVI標籤具有體積小、對融合蛋白整體構象干擾微弱等優點,因此在功能蛋白研究和結構生物學樣品準備中被頻繁採用。
AVI標籤的核心技術基礎是生物素化反應。生物素是一種維生素類共價修飾基團,能夠與鏈黴親和素(Streptavidin)形成極高親和力的非共價結合。在實驗體系中,通過體外或細胞內的BirA酶催化,生物素可以特異性附加到AVI標籤上。這種共價連接的穩定性超出常規非共價親和作用,使生物素化的AVI標籤蛋白能夠在複雜樣品背景下保持高結合能力。
在具體實驗操作流程中,生物素化往往分為兩種實現方式。一是體外生物素化,即在純化之前將表達獲得的AVI標籤蛋白與BirA酶、生物素及ATP等輔酶混合,通過優化緩衝體系和反應條件完成修飾。二是體內生物素化,即在表達宿主細胞中共表達BirA酶,使蛋白在翻譯過程中或翻譯後自動被標記。無論採用哪種方式,生物素化反應的效率評估通常採用質譜、親和檢測或功能驗證等手段。
完成生物素化後,AVI標籤蛋白能夠以極高的親和力與鏈黴親和素固定化介質結合。鏈黴親和素介質包括親和樹脂、磁珠、微孔板塗層等多種載體類型,可根據實驗需求和樣品特點選擇。例如,在蛋白親和純化過程中,生物素化的AVI標籤蛋白上樣到鏈黴親和素樹脂,經過適當洗滌步驟除去雜質後,可通過温和條件釋放結合的蛋白,獲得高純度樣品。這一親和策略尤其適用於低丰度蛋白、複雜背景物料和多步純化前的預富集。
除了親和純化應用外,AVI標籤在蛋白檢測領域同樣發揮重要作用。藉助鏈黴親和素與生物素的高親和作用,可以實現對AVI標籤蛋白的敏感檢測。在蛋白印跡(Western Blot)實驗中,生物素化後結合鏈黴親和素標記物(如鏈黴親和素‑HRP)進行檢測,可替代抗標籤抗體,實現蛋白表達驗證。在酶聯免疫吸附實驗(ELISA)中,生物素化的AVI標籤蛋白可作為捕獲抗原或檢測抗原,配合鏈黴親和素標記的顯色體系實現定量分析。此外,在免疫沉澱、蛋白–蛋白相互作用研究以及表面分析技術中(如表面等離子共振SPR、生物層干涉BLI),生物素化的AVI標籤蛋白可以被固定於傳感芯片表面,從而用於結合動力學和親和分析。
在選擇試劑和優化實驗流程時,科研人員需要關注生物素化效率、反應條件兼容性和結合穩定性等技術要點。體外生物素化反應受緩衝體系、pH、温度和輔酶濃度等因素影響,而體內生物素化則依賴宿主細胞的表達能力、BirA酶活性和分子伴侶系統。因而在設計實驗時,應根據目標蛋白的性質、實驗目的和檢測平台合理選擇生物素化方式,並結合適當的對照實驗評估標記效率。
儘管AVI標籤被廣泛應用於科研實驗中,但對標籤其本身的影響仍需謹慎評估。由於AVI標籤相對較短,一般不會對蛋白摺疊或功能造成明顯干擾,但在某些敏感體系或特定功能蛋白中,仍需考慮標籤位置(N端或C端)對活性或相互作用的潛在影響。因此在正式實驗前進行小規模驗證或比較不同構建方案,是確保實驗成功的重要步驟。
在蛋白試劑生態中,AVI標籤構建了一個完整的技術鏈條。從AVI標籤表達載體、BirA酶及其輔酶體系、生物素及其衍生物,到鏈黴親和素介質、鏈黴親和素標記的檢測試劑,這一系列科研試劑組合為蛋白純化和分析實驗提供了標準化、可重複的解決方案。科研人員在進行蛋白樣品準備、親和捕獲和功能分析時,可以根據實驗需求靈活選用這些試劑,以提升數據質量和實驗效率。AVI標籤技術因其高特異性、可控修飾和廣泛適配性,是當前重組蛋白研究中重要的標籤技術。