在病毒學與感染性疾病的基礎研究領域,柯薩奇病毒(Coxsackievirus)作為一種重要的病原體模型,其精細的分子結構與獨特的生命週期機制,持續為科研人員揭示病毒致病原理提供關鍵視角。
一、 柯薩奇病毒的病毒學分類與顆粒結構
柯薩奇病毒屬於小RNA病毒科(Picornaviridae)腸道病毒屬(Enterovirus)。根據其在新生小鼠體內致病性的差異,傳統上分為A組(CVA)和B組(CVB),其中CVB與人類心肌炎、胰腺炎等疾病關係尤為密切。
從結構生物學角度看,柯薩奇病毒是一種無包膜、二十面體對稱的球形病毒顆粒,直徑約為30納米。其衣殼由60個重複的原聚體單元組裝而成,每個原聚體包含四種病毒蛋白(Viral Protein,VP):VP1、VP2、VP3和VP4。這四種蛋白由一條約7.4kb的單股正鏈RNA基因組編碼的多聚蛋白前體,經病毒蛋白酶切割而成。
VP1、VP2、VP3:構成衣殼的外表面,決定了病毒的血清型和抗原性。VP1是主要的抗原決定簇所在區域,負責與宿主細胞受體特異性結合,是中和抗體的主要靶點。
VP4:位於衣殼內側,與病毒基因組RNA相連,在病毒進入細胞後,參與病毒基因組從衣殼中的釋放。
病毒衣殼表面存在一個稱為“峽谷”的結構,其底部即是細胞受體結合位點。這一深度結構有助於病毒逃避宿主免疫系統的識別,同時精準地錨定宿主細胞。
二、 病毒基因組與編碼蛋白的功能原理
柯薩奇病毒的基因組RNA本身具有mRNA功能,其序列包含一個長的開放閲讀框, flanked by 5‘和3’非翻譯區(UTR)。5‘ UTR內部存在內部核糖體進入位點(IRES),驅動病毒蛋白的帽非依賴性翻譯。
基因組翻譯產生一個多聚蛋白前體,隨後主要經由病毒自身編碼的2A蛋白酶和3C蛋白酶進行高效、有序的切割,最終產生成熟的病毒結構蛋白與非結構蛋白。
結構蛋白:最終形成病毒衣殼,功能是保護基因組並介導細胞入侵。
非結構蛋白:是病毒複製機器和調控宿主細胞環境的核心組件,包括:
2A蛋白酶:具有膽鹼蛋白酶活性,首先催化自身從多聚蛋白上切離。它不僅負責切割病毒多聚蛋白,還能切割宿主細胞的真核起始因子4G(eIF4G),關閉宿主細胞的蛋白質合成,迫使細胞資源轉向病毒蛋白生產。
2B與2BC蛋白:可改變內質網等細胞器的膜通透性,促進病毒粒子組裝所需的環境,並幫助病毒釋放。
3C蛋白酶:是切割病毒多聚蛋白大多數位點的主要蛋白酶,具有類似於胰蛋白酶的活性。它也能切割多種宿主蛋白,參與拮抗宿主免疫應答。
3D蛋白:即RNA依賴性RNA聚合酶(RdRP),負責以病毒正鏈RNA為模板合成負鏈RNA,再以負鏈RNA為模板大量複製子代病毒的正鏈RNA。它是病毒複製的核心引擎。
三、 重組柯薩奇病毒蛋白的技術原理與應用基礎
基於上述分子生物學知識,利用重組DNA技術,可在體外系統中(如大腸桿菌、昆蟲細胞或哺乳動物細胞)表達並純化出特定的柯薩奇病毒蛋白。這些重組蛋白是研究其生物功能的基石工具。
衣殼蛋白(尤其是VP1):重組表達的VP1蛋白可摺疊形成特定的空間構象,模擬其天然狀態下的抗原表位。這使得它能夠用於研究抗體-抗原相互作用的分子細節,或作為探針尋找新的細胞受體。共表達VP1、VP0(VP2+VP4前體)、VP3可自組裝成病毒樣顆粒,其在形態和抗原性與真實病毒高度相似,但無感染性,為安全研究病毒組裝和免疫識別提供了理想模型。
非結構蛋白酶(2A、3C):重組表達的2A和3C蛋白酶已成為分子生物學中的常用工具酶。研究者利用其高度特異的切割活性,在構建多基因表達載體或純化後去除重組蛋白標籤等方面具有獨特價值。
RNA聚合酶(3D):重組的3D蛋白可用於建立體外複製體系,在無細胞環境下詳細研究病毒RNA合成的起始、延伸機制,以及評估核苷酸類似物等化合物對其活性的抑制效果,是闡明病毒複製原理和篩選潛在作用靶點的核心手段。
四、 病毒的生命週期概覽
理解這些蛋白的功能,需將其置於完整的病毒生命週期背景中:
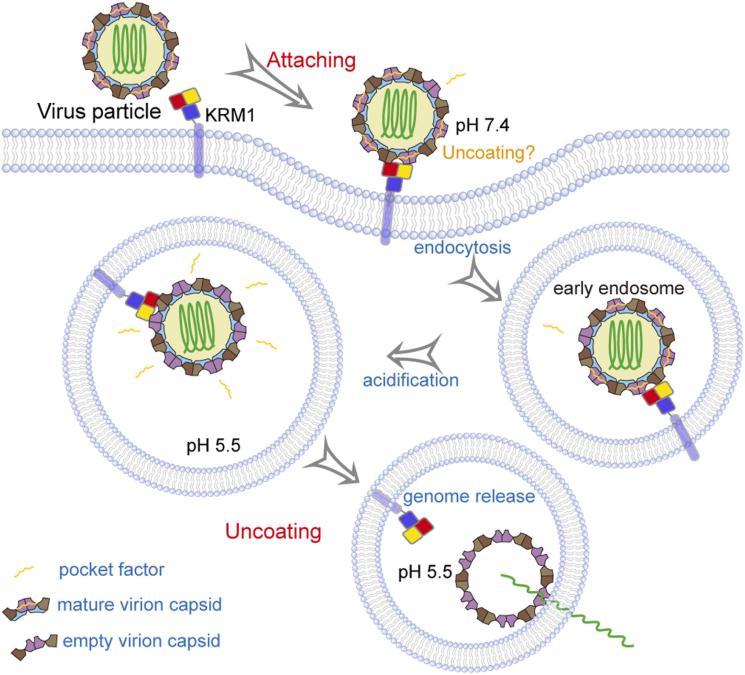
附着與進入:病毒通過VP1“峽谷”區域與宿主細胞表面特異性受體(如CVB使用的柯薩奇-腺病毒受體CAR)結合,觸發構象改變,導致VP4釋放,病毒基因組經內吞途徑進入細胞質。
基因組釋放與翻譯:病毒RNA脱去衣殼,直接利用宿主細胞的核糖體,通過IRES機制翻譯出病毒多聚蛋白。
多聚蛋白加工與複製複合體形成:2A、3C蛋白酶逐級切割多聚蛋白,產生功能蛋白。非結構蛋白會誘導細胞膜重排,形成富含脂質的“複製細胞器”,為3D聚合酶複製病毒RNA提供物理場所和原料。
衣殼組裝與病毒釋放:新合成的子代RNA與大量合成的結構蛋白在細胞質中包裝,組裝成成熟的病毒顆粒。最終,細胞裂解,釋放出大量子代病毒。
